domingo, 9 de septiembre de 2018
sábado, 8 de septiembre de 2018
Contaminación Ambiental
Se denomina contaminación ambiental a la presencia en el ambiente de cualquier agente (físico, químico o biológico), o bien de una combinación de varios agentes en lugares, formas y concentraciones tales que sean o puedan ser nocivos para la salud, la seguridad o para el bienestar de la población, o bien, que puedan ser perjudiciales para la vida vegetal o animal, o impidan el uso normal de las propiedades y lugares de recreación y goce de los mismos.
La contaminación ambiental es también la incorporación a los cuerpos receptores de sustancias sólidas, liquidas o gaseosas, o mezclas de ellas, siempre que alteren desfavorablemente las condiciones naturales del mismo, o que puedan afectar la salud, la higiene o el bienestar del público.
La contaminación es uno de los problemas ambientales más importantes que afectan a nuestro planeta y surge cuando se produce un desequilibrio, como resultado de la adición de cualquier sustancia al medio ambiente, en cantidad tal, que cause efectos adversos en el hombre, en los animales, vegetales o materiales expuestos a dosis que sobrepasen los niveles aceptables en la naturaleza.
La contaminación puede surgir a partir de ciertas manifestaciones de la naturaleza (fuentes naturales), o bien, debido a los diferentes procesos productivos del hombre (fuentes antropogénicas), que conforman las actividades de la vida diaria.
Las fuentes que generan contaminación de origen antropogénico más importantes son: industriales (frigoríficos, mataderos y curtiembres, actividad minera y petrolera), comerciales (envolturas y empaques), agrícolas (agroquímicos), domiciliarias (envases, pañales, restos de jardinería) y fuentes móviles (gases de combustión de vehículos).
Como fuente de emisión se entiende el origen físico o geográfico donde se produce una liberación contaminante al ambiente, ya sea al aire, al agua o al suelo. Tradicionalmente el medio ambiente se ha dividido, para su estudio y su interpretación, en esos tres componentes que son: aire, agua y suelo; sin embargo, esta división es meramente teórica, ya que la mayoría de los contaminantes interactúan con más de uno de los elementos del ambiente.
Los laboratorios del Departamento de Salud Ambiental realizan métodos de ensayo, procedimientos normalizados reconocidos internacionalmente, o procedimientos de referencias bibliográficas que pueden ser adaptadas si lo amerita el caso, pero debidamente validadas.
La Sección Química Ambiental está capacitada para realizar análisis de residuos orgánicos e inorgánicos en matrices ambientales tales como muestras de suelo, muestras de aguas, residuos mineros, residuos agrícolas, etc. Análisis en muestras de aguas, análisis de residuos peligrosos y análisis de componentes químicos presentes en juguetes y artículos escolares.
nomenclaturas
Se nombran del mismo modo que los hidrocarburos de cadena abierta de igual número de carbonos pero anteponiendo el prefijo ciclo.
| Ciclopropano | 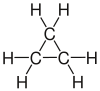 | |
|---|---|---|
| Ciclobutano |  |
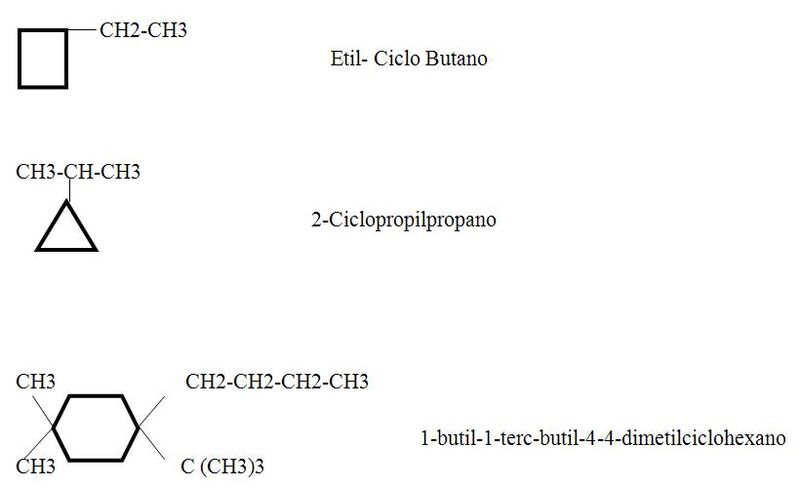
Los cicloalcanos con cadenas laterales se deben nombrar de la siguiente forma:
- El nombre de la cadena o radical que las forma en primer lugar si existe una ramificación se nombra sucesivamente los radicales con indicación de su posición correspondiente.
Resultan más sencillos nombrarlos como derivados de un cicloalcano que no como derivados de un compuesto de cadena abierta. 

Estos compuestos es mejor nombrar como derivados de un alcano de cadena abierta.
Se da nombre a los sustituyentes del anillo- grupos alquilo, halógenos y sus posiciones se señalan con números. Asignamos la posición 1 a un carbono en particular y luego numeramos alrededor del anillo en el sentido de las manecillas del reloj o en el contrario, hacemos todo esto de modo que resulte la combinación de números más bajos.
Propiedades físicas
Tienen características especiales debidas a la tensión del anillo. Esta tensión es a su vez de dos tipos:
- Tensión de anillo torsional o de solapamiento.
- Tensión de ángulo de enlace o angular.
El ángulo de los orbitales sp3 se desvía del orden de los 109º a ángulos inferiores.
Es especialmente inestable el ciclopropano cuya reactividad es similar a la de los alquenos.
Propiedades Químicas
Su reactividad (con excepción de los anillos muy pequeños: ciclopropano, ciclobutano y ciclopentano) es casi equivalente a la de los compuestos de cadena abierta.
Los puntos de fusión y ebullición son superiores a los de cadena abierta debido a que las estructuras cristalinas son más compactas y también las densidades son más altas. También se observa una alternancia en los valores de los puntos de fusión y ebullición entre los que tienen número par y número impar de carbonos.
Presencia
Los cicloalcanos aparecen de forma natural en diversos petróleos. Los terpenos, a que pertenecen una gran cantidad de hormonas como el estrógeno, el colesterol, la progesterona o la testosterona; y otras sustancias como el alcanfor, suelen presentar un esqueleto policíclico.
Los monociclos con anillos mayores (14 - 18 átomos de carbono) están presentes en las segregaciones de las glándulas del almizcle, utilizado en perfumería.
Algunos cicloalcanos
Ciclopropano
Artículo principal: Ciclopropano
El cicloalcano más simple, formado por tres átomos de carbono, es el ciclopropano. Se genera por la reacción de Wurtz intramolecular a partir de 1,3-dibromopropano con sodio o zinc. Se trata de una sustancia muy inestable y reactiva debido a la elevada tensión del anillo.
Todos sus enlaces se encuentran en posición eclipsada. Los ángulos de enlace se desvian desde los 109º a los 60º. El esqueleto de la molécula es un triángulo, por tanto la molécula es plana.
Su reactividad es parecida a la de los alquenos. En particular, son típicas las reacciones de adición con los halógenos (p. ej. con Cl2, Br2,...) que conllevan la apertura del anillo, y por tanto, están favorecidas por la disminución de la tensión angular en el seno de la molécula.
Sus derivados se encuentran en algunas sustancias biológicamente activas. Se generan convenientemente a partir del alqueno correspondiente mediante adición de un carbono.
Ciclobutano
Artículo principal: Ciclobutano
El siguiente cicloalcano más simple, formado por cuatro átomos de carbono, es el ciclobutano.
Tiene enlaces en posición alternada. Los ángulos de enlace se desvian desde los 109º a los 88º.1 El esqueleto de la molécula es un rombo ligeramente plegado, la molécula no es plana.
Ciclopentano
Está formado por cinco átomos de carbono.
Los ángulos de enlace se desvian desde los 109,5º a los 108º. Por tanto, la tensión angular es mínima en este cicloalcano. El esqueleto de la molécula es un pentágono ligeramente plegado, ya que la molécula no es plana. Esto es debido a que, en la conformación plana, existen 10 átomos de hidrógeno eclipsados, lo cual supone un aumento de energía de unas 10 kcal/mol. Por lo tanto, el ciclopentano presenta su menor energía estructural en una conformación no planar, en la que uno de los vértices del pentágono está fuera del plano formado por los otros cuatro, evitando entonces tanto enclipsamiento. Ciertos autores denominan a esta estructura "conformación de sobre" [1]. Con ángulos de enlace muy próximos a los 109,5º de la hibridación sp3, la molécula del ciclopentano carece, prácticamente, de tensión anular.
Ciclohexano
Probablemente el cicloalcano más importante es el ciclohexano. Se puede obtener por hidrogenación del benceno.
Presenta varias conformaciones que le permiten conservar el ángulo tetraédrico de 109,5 º entre los sustituyentes en los átomos de carbono. El ciclohexano no es plano sino, su diferentes conformaciones son denominadas de silla, y de bote. La forma de bote está ligeramente más elevada en energía que la forma de silla, por lo que no es tan estable.
Cicloalcanos de ciclo grande
Los cicloalcanos de tamaño mayor se generan a menudo a partir de las sales de torio de los ácidos dicarboxílicos correspondientes HOOC-(CH2)n-COOH (Síntesis de anillos largos de Ruzicka). El torio fuerza los dos extremos del ácido a unirse y luego calentando se produce bajo decarboxilación el cierre del anillo. La ciclocetona así generada puede ser reducida
Aplicaciones
Algunos cicloalcanos como el ciclohexano forman parte de la gasolina. Además se utiliza como intermedio en la síntesis de la caprolactama y por lo tanto en la obtención de las poliamidas.
El ciclohexano, la decalina (perhidronaftalina), el metilciclohexano y el ciclopentano se utilizan también como disolventes.
Moléculas y Átomos
El átomo es la menor fracción en la que se puede dividir un elemento simple, pero sin perder sus propiedades primas y pudiendo ser un objetivo de alguna reacción química. Esta formada por protones y neutrones, situados en el núcleo, ya que concentra casi toda la masa atómica, y a cuyo alrededor giran unos numerosos de electrones igual al de protones.
El concepto de átomo como una partícula invisible ya se encontraba en Grecia. En 1803 Dalton emitió la hipótesis atómica: los elementos están formados por átomos y los compuestos por grupos de estos (moléculas). Los elementos de Thomson (1897) con rayos catódicos y la identificación de estos con los corpúsculos llamados electrones, constituyentes de la electricidad, indicaron la posibilidad de que el átomo fuera divisible en componentes (partículas). Los trabajos de Rutherford (1911) bombardeando láminas metálicas con partículas alfa llegaron a distinguir en el átomo un núcleo pequeño con un diámetro de 10-12 cm y pesado y una nube electrónica dispuesta en capas concéntricas que abarcaban un diámetro 10-8 cm.
El átomo mas sencillo es el de hidrógeno, consta de un solo protón y un solo electrón, los átomos más complejos tienen en el núcleo tantos nucleones como indica su masa atómica, de los cuales son protones (con carga positiva) en cantidad igual al número atómico (número de orden en la tabla periódica) y neutrones (sin carga) el resto. La carga positiva del núcleo se contrarresta con una igual de sentido contrario correspondiente a los electrones de la corteza atómica.
En 1913, N. Bohr, basándose en los conocimientos que facilitaba la mecánica cuántica, y para explicar de modo adecuado las líneas espectrales, presentó un modelo atómico que establecía y cuantificaba (mediante los números cuánticos) la distribución de los electrones alrededor del núcleo, la forma orbital en que se movían y las condiciones bajo las cuales éstos saltaban de una a otra órbita. Posteriormente, Sommerfeld completó el mencionado modelo con un tercer número cuántico, con el que precisó que las órbitas electrónicas eran elípticas y no coplanarias.
En 1925, Uhlenbeck y Goudsmit demostraron que los electrones atómicos tienen un movimiento de rotación, que se define con un cuarto número cuántico. El estudio del núcleo atómico ha dado lugar a la física nuclear, y ésta ha puesto de manifiesto la existencia de numerosas partículas subatómicas. Las teorías ondulatorias de E. Schrödinger sobre las partículas elementales hacen considerar los niveles energéticos u orbitales de N. Bohr bajo una nueva perspectiva, en la que el concepto de posición de un partícula se convierte en la probabilidad de presencia de una onda estacionaria.
Una molécula es una partícula formada por una agrupación ordenada y definida de átomos, que constituye la menor porción de un compuesto químico que puede existir en libertad.
Aún las moléculas muy grandes son tan pequeñas que no seríamos capaces de ver a una molécula de una sustancia. Pero cuando cientos de moléculas se encuentran juntas, podrían estar en forma de un vaso de agua, el árbol de un bosque, la pantalla de la computadora; dependiendo del tipo de moléculas que sean.
Las moléculas sólo se hallan perfectamente individualizadas en los gases en estado de movimiento rectilíneo desordenado, en cuyo caso su interacción se limita a choques muy breves. En los líquidos, si bien las moléculas se desplazan libremente, existe un mayor contacto intermolecular. En los sólidos, las moléculas ocupan por lo general posiciones fijas en los nudos de redes cristalinas. Los agregados atómicos moleculares pueden ser polares o no polares. En el primer caso, las moléculas forman pequeños dipolos y es la atracción que se manifiesta entre éstos lo que causa la unión intermolecular.
Las dimensiones de la molécula dependen de las características y del número de los átomos que la forman, y pueden ir desde 2,4 ångström (molécula de hidrógeno) hasta longitudes perceptibles a simple vista (moléculas orgánicas o macromoléculas). La masa de las moléculas es extremadamente pequeña, ya que guarda relación con sus dimensiones, lo que hace evidente la necesidad de recurrir a unidades de masa especiales, tales como la molécula gramo o mol, que equivale a la masa de un cuerpo que en estado gaseoso ocupa el mismo volumen que 32 g de oxígeno (dado que la molécula de este elemento consta de dos átomos).
En el transcurso de las reacciones químicas a las que se ven sometidas, las moléculas experimentan todo tipo de transformaciones (divisiones, uniones, cambios de parte de sus átomos, etc.), lo que permite la formación de nuevas moléculas (es decir, de nuevos cuerpos).
ejemplos de moléculas:
- H2O --> Agua
- CH4 --> Metano
- NH3 --> Amoniaco
- H2 SO4 - ácido sulfúrico
- NaCl -Sal de cocina o sal común
- CaCO3 - Carbonato de Calcio
- NH3 - Amoniaco
El concepto de átomo como una partícula invisible ya se encontraba en Grecia. En 1803 Dalton emitió la hipótesis atómica: los elementos están formados por átomos y los compuestos por grupos de estos (moléculas). Los elementos de Thomson (1897) con rayos catódicos y la identificación de estos con los corpúsculos llamados electrones, constituyentes de la electricidad, indicaron la posibilidad de que el átomo fuera divisible en componentes (partículas). Los trabajos de Rutherford (1911) bombardeando láminas metálicas con partículas alfa llegaron a distinguir en el átomo un núcleo pequeño con un diámetro de 10-12 cm y pesado y una nube electrónica dispuesta en capas concéntricas que abarcaban un diámetro 10-8 cm.
El átomo mas sencillo es el de hidrógeno, consta de un solo protón y un solo electrón, los átomos más complejos tienen en el núcleo tantos nucleones como indica su masa atómica, de los cuales son protones (con carga positiva) en cantidad igual al número atómico (número de orden en la tabla periódica) y neutrones (sin carga) el resto. La carga positiva del núcleo se contrarresta con una igual de sentido contrario correspondiente a los electrones de la corteza atómica.
En 1913, N. Bohr, basándose en los conocimientos que facilitaba la mecánica cuántica, y para explicar de modo adecuado las líneas espectrales, presentó un modelo atómico que establecía y cuantificaba (mediante los números cuánticos) la distribución de los electrones alrededor del núcleo, la forma orbital en que se movían y las condiciones bajo las cuales éstos saltaban de una a otra órbita. Posteriormente, Sommerfeld completó el mencionado modelo con un tercer número cuántico, con el que precisó que las órbitas electrónicas eran elípticas y no coplanarias.
En 1925, Uhlenbeck y Goudsmit demostraron que los electrones atómicos tienen un movimiento de rotación, que se define con un cuarto número cuántico. El estudio del núcleo atómico ha dado lugar a la física nuclear, y ésta ha puesto de manifiesto la existencia de numerosas partículas subatómicas. Las teorías ondulatorias de E. Schrödinger sobre las partículas elementales hacen considerar los niveles energéticos u orbitales de N. Bohr bajo una nueva perspectiva, en la que el concepto de posición de un partícula se convierte en la probabilidad de presencia de una onda estacionaria.
Una molécula es una partícula formada por una agrupación ordenada y definida de átomos, que constituye la menor porción de un compuesto químico que puede existir en libertad.
Aún las moléculas muy grandes son tan pequeñas que no seríamos capaces de ver a una molécula de una sustancia. Pero cuando cientos de moléculas se encuentran juntas, podrían estar en forma de un vaso de agua, el árbol de un bosque, la pantalla de la computadora; dependiendo del tipo de moléculas que sean.
Las moléculas sólo se hallan perfectamente individualizadas en los gases en estado de movimiento rectilíneo desordenado, en cuyo caso su interacción se limita a choques muy breves. En los líquidos, si bien las moléculas se desplazan libremente, existe un mayor contacto intermolecular. En los sólidos, las moléculas ocupan por lo general posiciones fijas en los nudos de redes cristalinas. Los agregados atómicos moleculares pueden ser polares o no polares. En el primer caso, las moléculas forman pequeños dipolos y es la atracción que se manifiesta entre éstos lo que causa la unión intermolecular.
Las dimensiones de la molécula dependen de las características y del número de los átomos que la forman, y pueden ir desde 2,4 ångström (molécula de hidrógeno) hasta longitudes perceptibles a simple vista (moléculas orgánicas o macromoléculas). La masa de las moléculas es extremadamente pequeña, ya que guarda relación con sus dimensiones, lo que hace evidente la necesidad de recurrir a unidades de masa especiales, tales como la molécula gramo o mol, que equivale a la masa de un cuerpo que en estado gaseoso ocupa el mismo volumen que 32 g de oxígeno (dado que la molécula de este elemento consta de dos átomos).
En el transcurso de las reacciones químicas a las que se ven sometidas, las moléculas experimentan todo tipo de transformaciones (divisiones, uniones, cambios de parte de sus átomos, etc.), lo que permite la formación de nuevas moléculas (es decir, de nuevos cuerpos).
ejemplos de moléculas:
- H2O --> Agua
- CH4 --> Metano
- NH3 --> Amoniaco
- H2 SO4 - ácido sulfúrico
- NaCl -Sal de cocina o sal común
- CaCO3 - Carbonato de Calcio
- NH3 - Amoniaco
La química orgánica o química del carbono
es la rama de la química que estudia una numerosa clase de moléculas que contienen carbono, formando enlaces covalentes carbono-carbono y carbono-hidrógeno, también conocidos como compuestos orgánicos. Su riqueza es abrumadora. Originalmente, la química orgánica se confundió con la bioquímica, al estar la química de la vida basada mayoritariamente en la química del carbono. Desde la primera síntesis de urea en un laboratorio, que demostró que la química orgánica no era fundamentalmente distinta de la química convencional, se han realizado enormes avances teóricos y metodológicos, se han sintetizado y descrito millones de compuestos orgánicos y se han basado ramas enteras de la industria en las reacciones químicas orgánicas.
La física moderna
comienza a principios del siglo xx, cuando el alemán Max Planck investiga sobre el “cuanto” de energía. Planck decía que eran partículas de energía indivisibles, y que éstas no eran continuas como decía la física clásica. Por ello nace esta nueva rama de la física, que estudia las manifestaciones que se producen en los átomos, los comportamientos de estas partículas que forman la materia y las fuerzas que las rigen. Se conoce, generalmente, por estudiar los fenómenos que se producen a la velocidad de la luz o valores cercanos a ella, o cuyas escalas espaciales son del orden del tamaño del átomo o inferiores.
Los temas anteriormente tratados de la física clásica no servían para resolver los problemas presentados, ya que estos se basan en certezas y la física moderna en probabilidades, lo que provocó dificultades para adaptarse a las nuevas ideas.
En 1905, Albert Einstein publicó una serie de trabajos que revolucionaron la física, principalmente representados por “La dualidad onda-partícula de la luz” y “La Teoría de la Relatividad” entre otros. Estos y los avances científicos como el descubrimiento de la existencia de otras galaxias, la superconductividad, el estudio del núcleo del átomo, y otros, permitieron lograr que años más tarde surgieran avances tecnológicos, como la invención del televisor, los rayos x, el radar, fibra óptica, el computador, etc.
La misión final de la física actual es comprender la relación entre las fuerzas que rigen la naturaleza, la gravedad, el electromagnetismo, la fuerza nuclear fuerte y la fuerza nuclear débil. Comprender y lograr una teoría de unificación, para así poder entender el universo y sus partículas.
Se divide en:
Casi todo lo planteado en el siglo XIX fue puesto en duda y al final fue remplazado durante el siglo XX, y de esta misma forma puede ocurrir actualmente, a medida que se produzcan resultados como en las nuevas investigaciones, y se materialicen los nuevos conocimientos que se irán adquiriendo durante este nuevo siglo.
Termodinámica

Máquina térmica típica donde puede observarse la entrada desde una fuente de calor (caldera) a la izquierda y la salida a un disipador de calor (condensador) a la derecha. El trabajo se extrae en este caso mediante una serie de pistones.
La termodinámica es la rama de la física que describe los estados de equilibrio termodinámico a nivel macroscópico. El Diccionario de la lengua española de la Real Academia, por su parte, define la termodinámica como la rama de la física encargada del estudio de la interacción entre el calor y otras manifestaciones de la energía.1 Constituye una teoría fenomenológica, a partir de razonamientos deductivos, que estudia sistemas reales, sin modelizar y sigue un método experimental.2 Los estados de equilibrio se estudian y definen por medio de magnitudes extensivas tales como la energía interna, la entropía, el volumen o la composición molar del sistema,3 o por medio de magnitudes no-extensivas derivadas de las anteriores como la temperatura, presión y el potencial químico; otras magnitudes, tales como la imanación, la fuerza electromotriz y las asociadas con la mecánica de los medios continuos en general también pueden tratarse por medio de la termodinámica.4
La termodinámica ofrece un aparato formal aplicable únicamente a estados de equilibrio,5 definidos como aquel estado hacia «el que todo sistema tiende a evolucionar y caracterizado porque en el mismo todas las propiedades del sistema quedan determinadas por factores intrínsecos y no por influencias externas previamente aplicadas».3 Tales estados terminales de equilibrio son, por definición, independientes del tiempo, y todo el aparato formal de la termodinámica –todas las leyes y variables termodinámicas– se definen de tal modo que podría decirse que un sistema está en equilibrio si sus propiedades pueden describirse consistentemente empleando la teoría termodinámica.3 Los estados de equilibrio son necesariamente coherentes con los contornos del sistema y las restricciones a las que esté sometido. Por medio de los cambios producidos en estas restricciones (esto es, al retirar limitaciones tales como impedir la expansión del volumen del sistema, impedir el flujo de calor, etc.), el sistema tenderá a evolucionar de un estado de equilibrio a otro;6 comparando ambos estados de equilibrio, la termodinámica permite estudiar los procesos de intercambio de masa y energía térmica entre sistemas térmicos diferentes.
Como ciencia fenomenológica, la termodinámica no se ocupa de ofrecer una interpretación física de sus magnitudes. La primera de ellas, la energía interna, se acepta como una manifestación macroscópica de las leyes de conservación de la energía a nivel microscópico, que permite caracterizar el estado energético del sistema macroscópico.7 El punto de partida para la mayor parte de las consideraciones termodinámicas son los que postulan que la energía puede ser intercambiada entre sistemas en forma de calor o trabajo, y que solo puede hacerse de una determinada manera. También se introduce una magnitud llamada entropía,8 que se define como aquella función extensiva de la energía interna, el volumen y la composición molar que toma valores máximos en equilibrio: el principio de maximización de la entropía define el sentido en el que el sistema evoluciona de un estado de equilibrio a otro.9 Es la mecánica estadística, íntimamente relacionada con la termodinámica, la que ofrece una interpretación física de ambas magnitudes: la energía interna se identifica con la suma de las energías individuales de los átomos y moléculas del sistema, y la entropía mide el grado de orden y el estado dinámico de los sistemas, y tiene una conexión muy fuerte con la teoría de información.10 En la termodinámica se estudian y clasifican las interacciones entre diversos sistemas, lo que lleva a definir conceptos como sistema termodinámico y su contorno. Un sistema termodinámico se caracteriza por sus propiedades, relacionadas entre sí mediante las ecuaciones de estado. Estas se pueden combinar para expresar la energía interna y los potenciales termodinámicos, útiles para determinar las condiciones de equilibrio entre sistemas y los procesos espontáneos.
Con estas herramientas, la termodinámica describe cómo los sistemas reaccionan a los cambios en su entorno. Esto se puede aplicar a una amplia variedad de ramas de la ciencia y de la ingeniería, tales como motores, cambios de fase, reacciones químicas, fenómenos de transporte, e incluso agujeros negros.
viernes, 7 de septiembre de 2018
PLANETA TIERRA
Te explicamos qué es la Tierra, cuándo y cómo se formó este planeta, su composición y cuáles son sus características principales.

¿Qué es el planeta Tierra?
La Tierra es el tercer planeta del sistema solar, en órbita alrededor del Sol entre Venus y Marte, eso es, a 149.600.000 km del Astro Rey. Es el más grande y más denso de los llamados planetas Terrestres, y el quinto en tamaño de los ocho que existen. Es, además, el único planeta hasta la fecha capaz de albergar vida orgánica tal y como la conocemos.
Su nombre proviene de la antigua mitología romana: Terra, encarnación de una diosa primigenia a quien se asociaba la femineidad, la fecundidad y el origen de la mayoría de las cosas. Se le asocia con la maternidad en diversas culturas, como la Pachamama de los Incas o la Madre Tierra occidental.
La Tierra tiene un único satélite natural al que llamamos La Luna, en órbita a tan sólo 384.400 km de distancia de la superficie. La Luna es el cuarto satélite más grande del sistema solar y mide la cuarta parte de la Tierra.
Características del planeta TierrA
El origen de la Tierra y de los demás planetas está en la nebulosa solar, un disco de materia remanente de la formación misma del Sol. Se ha calculado que hace 4550 millones de años ya existía la Tierra, después de un período de enfriamiento y constitución de aproximadamente unos 10 a 20 millones de años, cuyo resultado final fue la conformación de las capasexteriores de la superficie terrestre y de la Luna, producto de un impacto entre un cuerpo más o menos del tamaño de Marte con La Tierra hace unos 4530 millones de años.
Luego ocurrió una paulatina desgasificación de la corteza del planeta, que junto a la incipiente actividad volcánica, iniciaron los procesos químicos que darían como resultado la atmósfera terrestre. Similarmente, la aparición del agua de los océanos, preludio a la vida, se debió a la introducción de hielo y agua líquida en cometas, asteroides o protoplanetas que hicieron impacto en la joven Tierra.
Movimientos

La Tierra tiene tres formas distintas de movimiento: rotación, traslación y oblicuidad.
- Rotación. La Tierra gira en torno a su propio eje, en dirección Oeste-Este, y demora 23 horas, 56 minutos y 4 segundos en completar un giro. Este movimiento da origen al día y la noche, alternando entre la cara expuesta y oculta al Sol.
- Traslación. La órbita terrestre alrededor del Sol tiene un perímetro de 930 millones de kilómetros, a una velocidad de 108.000 kilómetros por hora. Eso significa que una vuelta orbital completa se lleva a cabo cada 365 días, 5 horas, 48 minutos y 45 segundos. A dicho período es lo que llamamos comúnmente año.
- Oblicuidad. La Tierra se inclina sobre el plano de su elíptica en poco más de 23°, y es responsable de las estaciones del año, pues acerca y aleja ciertas latitudes planetarias al Sol. Este movimiento disminuye a razón de 0,47” por año.
Atmósfera

La bola de gases que rodea a la superficie terrestre, presa de su fuerza de gravedad, se denomina la atmósfera. Se compone de un 78% de nitrógeno, un 21% de oxígeno y el resto de gases nobles y se extiende desde la superficie terrestre hasta unos 11 km de altura (en el 75% de su contenido). Sin embargo, no hay límites definidos de la atmósfera, pues empieza en algún momento a desvanecerse en el espacio.
A la naturaleza atmosférica se deben los fenómenos climáticos y la redistribución de la energía térmica, así como la aparición de la capa de ozono, indispensable para la preservación de la vida del impacto directo de la radiación UV del Sol.
Ver además: Características de la Atmósfera
Composición y estructura interna

La Tierra pertenece a los planetas terrestres, es decir, que se trata de un cuerpo rocoso y no gaseoso, como Júpiter. El cuerpo terrestre se compone de distintos niveles o capas geológicas, a saber:
- Litósfera. Compuesta por la superficie, corteza y manto superior terrestres, es la capa que se extiende desde los 0 a 60 km de profundidad. Es la capa más fría y rígida de todas. De ello se componen las capas tectónicas.
- Astenósfera. Una capa viscosa sobre la que flota la litósfera, va de los 100 a los 700 km de profundidad.
- El manto. Se denomina así a la capa entre 35 y 2890 km de profundidad, aunque sea una serie de niveles geológicos distintos.
- Núcleo externo. Una capa líquida de materia, de bajísima viscosidad, que rodea y descansa sobre un núcleo sólido.
- Núcleo interno. La esfera central de la Tierra, compuesta fundamentalmente por hierro, níquel y porcentajes bajos de azufre y oxígeno. El núcleo en total tiene 3500 km de espesor.
Proporciones

De los planetas terrestres, la Tierra es el más denso, poseedor del campo magnético más intenso y la gravedad superficial más alta, amén de la rotación más rápida. Esto la moldea como una esfera achatada (esferoide oblato) a la altura de sus polos, y abultada ligeramente a la altura del ecuador.
Posee una circunferencia ecuatorial de 40.091 km, un diámetro de 12.756 km y una masa de 5,973 x 1024 kg.
Superficie

La superficie total de la Tierra es de 510.072.000 km2, de los cuales 70,8% es agua y el 29,2% restante es tierra. El relieve de dicha superficie expuesta es una combinación de montañas, desiertos, llanuras y mesetas, mientras que la sumergida posee cañones, mesetas y dorsales submarinas, así como profundísimas llanuras abisales, donde no llega la luz solar.
La superficie terrestre se modifica a lo largo de los años, debido al movimiento subterráneo de las placas tectónicas, cuyos pliegues y colisiones generan diversos fenómenos de relieve.
Biósfera

Se entiende por biósfera el conjunto total de la vida orgánica en el planeta, en el contexto de sus emplazamientos físicos. Dividida en diversos biomas, de acuerdo a su latitud, altura sobre el nivel del mar y márgenes de humedad, se estima que haya empezado a evolucionar hace 3500 millones de años.
La biodiversidad planetaria es muy alta, privilegiando para ello las zonas bajas y húmedas como la Selva Tropical, mientras que las zonas altas y áridas son poco habitables por vida vegetal y animal.
En cada bioma existen diversos ecosistemas, en los que la vida se ha organizado a sí misma a partir de las relaciones posibles entre seres vivos. La masa total de la vida en el planeta es de más o menos 1 billón de toneladas de carbono.
Hidrósfera

Una diferencia fundamental de la Tierra respecto a otros planetas del Sistema Solar es su abundante presencia de agua. A esta superficie acuífera total se la conoce como hidrósfera, y abarca no sólo los extensos océanos y mares, sino lagos, ríos y aguas subterráneas hasta los 2 kilómetros de profundidad. La sumatoria de dicha masa de agua en el planeta es de 1/4400 de su masa total.
Los océanos se extienden por un área de 361,84×106 km2, con una profundidad promedio de 3682,2 metros y un volumen de 1,3324×109de km3. Eso significa que si la tierra se nivelase toda, el agua la cubriría totalmente hasta los 2,7m de altura.
Campo magnético

El campo magnético terrestre es el más grande de los planetas terrestres. Sus polos se identifican con los polos geográficos, si bien se supone su origen en el movimiento del núcleo metálico del planeta, que genera corrientes eléctricas.
Así se forma la magnetósfera, el campo magnético terrestre que, entre otras cosas, desvía las partículas del viento solar. Se estima el momento magnético dipolar del planeta en 7,91×1015 T m3. Dicha fuerza magnética se debilita hacia el ecuador.
Población humana

Repartidos a lo largo de los continentes, habitamos en el mundo unos 7 mil millones de seres humanos y se espera que esta cifra alcance los 9.200 millones para el año 2050. El continente mayormente poblado es Asia, y las estadísticas mundial apuntan a un 40% de población rural versus 60% de población urbana.
Las diversas naciones humanas (204 naciones soberanas para el año 2011) han reclamado en casi su totalidad la superficie terrestre, excepto por zonas amplias de la Antártida y una zona no reclamada entre Egipto y Sudán, llamada Bir Tawil. Aun así, apenas un octavo de la superficie terrestre sea habitable por los seres humanos.
Suscribirse a:
Comentarios (Atom)